Immune system development: Difference between revisions
No edit summary |
No edit summary |
||
| Line 30: | Line 30: | ||
=== Immune system organs === | === Immune system organs === | ||
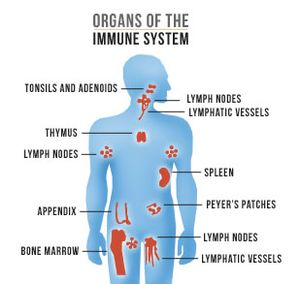
[[File:Organs of the | [[File:Organs of the Immune System by AIDS.gov.jpg|thumb|right|Organs of the immune system]] | ||
* [[thymus]] (brzlík), [[kostní dřeň]], lymfatické uzliny, [[slezina]], nosní a krční mandle, Peyerské plaky ve střevě, apendix | * [[thymus]] (brzlík), [[kostní dřeň]], lymfatické uzliny, [[slezina]], nosní a krční mandle, Peyerské plaky ve střevě, apendix | ||
Revision as of 11:59, 12 April 2022
Imunitní systém je souhrn mechanismů udržujících integritu organismu. Jedná se o komplexní systém buněk a molekul, které mají schopnost rozpoznávat a likvidovat cizí i vlastní potenciálně škodlivé struktury. Imunokompetentní buňky vznikají ze společné kmenové buňky v kostní dřeni a poté zrají a diferencují se v centrálních (primárních) lymfatických orgánech (kostní dřeň, thymus,..). Imunitní reakce probíhají v periferních (sekundárních) lymfatických orgánech, což jsou buď anatomicky definované struktury (lymfatické uzliny, slezina), nebo funkční celky (slizniční a kožní imunitní systém, imunitní systém jednotlivých orgánů). Poruchy struktury či funkce imunitního systému mohou způsobit zvýšenou náchylnost k infekcím, rozvoj autoimunitních onemocnění, alergií nebo nádorů.[1]
Structure of the immune system
| Přirozená imunita
(též antigenně nespecifická, vrozená, neadaptivní) |
buněčná | fagocyty |
| makrofágy | ||
| NK-buňky | ||
| humorální | komplement | |
| interferony (IFN) | ||
| Specifická imunita
(též získaná, adaptivní) |
buněčná | T-lymfocyty |
| humorální | B-lymfocyty → protilátky (Ig) |
- profesionální fagocyty: polymorfonukleární leukocyty (neutrofily) a monocyty-makrofágy;
- makrofágy – vznikají z monocytů vcestováním do tkání, v různých tkáních mají různé formy a různé názvy (lymfatické uzliny: histiocyty, kůže a a sliznice: Langerhansovy buňky, CNS: mikroglie, játra: Kupfferovy buňky, ledviny: intraglomerulární mesangiální buňky, kosti: osteoklasty,…);
- NK-buňky (natural killers) – cytotoxické lymfocyty, které jsou schopné rychle zabíjet buňky infikované virem a některé nádorové buňky.
Immune system organs
- thymus (brzlík), kostní dřeň, lymfatické uzliny, slezina, nosní a krční mandle, Peyerské plaky ve střevě, apendix
Cells of the immune system
- lymfoidní řada: T-lymfocyty (zprostředkovávají specifickou imunitní reakci), B-lymfocyty (zajišťují specifickou protilátkovou imunitu), NK buňky (cytotoxické buňky nespecifické imunity)
- myeloidní řada: monocyty – makrofágy (fagocytující buňky prezentující antigen), dendritické buňky, neutrofily (fagocytující buňky časné zánětlivé reakce), bazofily (buňky periferní krve účastnící se zánětlivé reakce), eozinofily (buňky účastnící se hypersenzitivní reakce a antiparazitární obrany), žírné buňky (buňky hypersenzitivní reakce I. typu)[2]
Development of the immune system
náhled|vpravo|Hematopoéza náhled|300px|Produkce buněk imunitního systému v prenatálním a postnatálním období Vývoj imunitního systému začíná již před narozením a pokračuje celý život. Buňky imunitního systému se vyvíjí z hematopoetických kmenových buněk, které jsou schopny neomezeného mitotického dělení.
Ve 3. týdnu gestace vzniká ve žloutkovém vaku pluripotentní hematopoetická kmenová buňka, která v 5. týdnu gestace putuje do fetálních jater (1. hematopoetický orgán embrya) a přechodně také do sleziny. Z jater se v 8.–11. týdnu gestace rozsévají kmenové buňky embryonální cirkulací do kostní dřeně, thymu, sleziny a lymfatických uzlin. Po porodu je jediným hematopoetickým orgánem kostní dřeň.
Novorozenec má funkční imunitní systém (je schopen humorální i buněčné imunitní odpovědi) a první měsíce života je navíc chráněn transplacentárně přenesenými protilátkami IgG od matky. K jejich přenosu dochází od 22. gestačního týdne díky specifickým Fc-receptorům v placentě. Kojený novorozenec je dále chráněn matčinými IgA získanými mateřským mlékem, nicméně tyto IgA chrání před patogeny v oblasti trávicího traktu a nevstupují do krevního oběhu novorozence.
Nejnižší hladina imunoglobulinů v séru kojence je kolem 4. až 6. měsíce věku, protože v tomto období již došlo k rozpadu pasivně získaných maternálních IgG a endogenní syntéza imunoglobulinů zatím není dostatečná. Právě v tomto období dochází ke klinické manifestaci humorálních imunodeficitů.[3][4]
T-cell development
Thymus je osídlen prekurzory T-buněk z fetálních jater („pro-T buňkami“). Dochází k vývoji TCR (T-cell receptors) a díky náhodné rekombinaci genů k enormní rozmanitosti TCR. Po expresi TCR následuje selekce:
- Pozitivní selekce – interakce nezralých tymocytů s nízkou expresí TCR s hlavním histokompatibilním komplexem (MHC, genetický systém zodpovědný za rozeznávání vlastního od cizorodého – především komplex HLA, Human Leucocyte Antigen) na epitelu (CD4 – HLA II, CD8 – HLA I) → selekce buněk schopných interakce s cizorodým antigenem (Ag) prezentovaným vlastním MHC.
- Negativní selekce – tymocyty s vysokou expresí TCR reagujícího s vlastními peptidy prezentovanými s HLA I nebo II na thymových makrofázích → indukce apoptózy → delece autoreaktivních klonů.
T-buňky poté migrují do sekundárních lymfatických orgánů.[3]
B-cell development
Vývoj B-lymfocytů probíhá v několika fázích:
- fáze bez přítomnosti Ag (antigen-independentní vývoj):
- V kostní dřeni se vyvýjí z progenitorových buněk: HLA-DR+, CD45+, CD34+, CD19+.
- Vyžaduje kontakt se stromálními buňkami kostní dřeně (VCAM-1 + časný lymfocyt VLA-4), cytokin SCF (Stem Cell Factor) a IL-7.
- Naivní (virgin) zralé B-lymfocyty mají na povrchu IgM, IgD.
- V kostní dřeni probíhá negativní selekce autoreaktivních klonů B-lymfocytů (těch, které silně reagují s vlastními Ag) – indukce apoptózy, indukce přeskupování genových segmentů pro BCR, zablokování a anergie.
- fáze s Ag stimulací (antigen-dependentní vývoj):
- V sekundárních lymfoidních orgánech (uzlina, slezina, sliznice) přichází B-lymfocyty do kontaktu s T-lymfocyty a antigen prezentujícími buňkami.
- Probíhá ve 2 fázích – primární a sekundární fáze protilátkové odpovědi:
- Primární fáze protilátkové odpovědi (primární odpověď)
- Probíhá v primárních lymfoidních folikulech (v uzlinách), kde B-lymfocyty interagují s Ag na APC a s Th2.
- Při styku naivního zralého B-lymfocytu s antigenem (Ag) dochází:
- k rozeznání antigenu (Ag) prostřednictvím antigenně specifických receptorů na B-lymfocytech (BCR = B-cell receptor);
- ke stimulaci B-lymfocytu vazbou BCR + Ag;
- k pohlcení Ag → prezentace Ag na HLA II. tř. prekurzorům Th-lymfocytů → vznik antigenně specifických Th2.
- B-lymfocyt = APC pro T-lymfocyt.
- Kontakt T-lymfocytů + B-lymfocytů je umožněn prostřednictvím CD28 + CD80/86, CD40L + CD40 a vede k pomnožení B-lymfocytů a diferenciaci na:
- Sekundární fáze protilátkové odpovědi (sekundární odpověď)
- po opakované expozici paměťové B-buňky antigenu dochází k produkci většího počtu buněk a je provázeno:
- afinitní maturací = změna BCR;
- vznikem sekundárních lymfatických folikulů s germinálním centrem;
- izotypovým přesmykem IgG, IgA, IgE;
- vznikem plazmatických a paměťových buněk s vyšší afinitou k Ag (somatické mutace Ig genů zvyšují afinitu protilátek).
- Výsledek sekundární odpovědi = Ig s vyšší afinitou k Ag, schopné aktivovat komplement a opsonizovat (IgG+FcR).[3]
Primární i sekundární odpověď na sebe v průběhu typických infekcí bezprostředně navazují a vedou ke vzniku paměťových buněk. Při opakované infekci (pozdější setkání s Ag):
- Přetrvává hladina Ig – bezprostřední potlačení infekce.
- Paměťové buňky rychle aktivovány k produkci vysokoafinitních Ig různých izotypů.[5]
- Terminální vyzrávání na plazmatické buňky:
- Diferenciace na paměťové bb. (pro určitý Ag) a plazmatické buňky (sekrece Ag-specifických Ig = protilátek).
- Ig izotypy: M, G, A, D, E.[3]
Postnatal lymphopoiesis
T -lymphocytes
V pupečníkové krvi je vyšší počet T-lymfocytů (CD3+) než u kojenců. Poměr CD4:CD8 je vyšší. T-lymfocyty mají schopnost odpovědět na mitogenní podnět a vyvolat antigen-specifickou odpověď (viz např. BCG vakcína).
B -lymphocytes
V pupečníkové krvi je vyšší počet B-lymfocytů. Ty ale ještě netvoří celé spektrum imunoglobulinů (Ig). Po stimulaci antigeny (Ag) zevního prostředí jsou nejprve tvořeny IgM (tato schopnost je i u nezralých B-lymfocytů). Celková hladina Ig je nejnižší kolem 3. až 4. měsíce věku. Schopnost tvorby Ig proti proteinovým Ag je přítomna od narození, ale schopnost tvorby Ig proti polysacharidovým Ag až od 2 let (není vhodná polysacharidová vakcína, ale je třeba použít konjugovanou vakcínu např. proti Haemophilus influenzae typ b). Novorozenec je náchylnější ke G- infekci, protože nedostatek IgM (= opsoninů) způsobuje nedokonalou fagocytózu polymorfonukleárů. Mateřské IgG mají funkci opsoninů pro většinu G+ bakterií, specifické IgGs proti běžným virům stačí. Nedonošenci mají méně mateřských IgG a tudíž i nižší opsonizační aktivitu pro všechny typy mikroorganismů.[3]
Development of lymphatic organs
- Thymus – při narození má 2/3 dospělé váhy, největší je těsně před pubertou, poté dochází k postupné involuci.
- Periferní lymfatické tkáně – dospělá velikost do 6 let věku, větší v prepubertálním období, pak involuce.
- Slezina – postupně roste do dospělosti.
- Peyerské plaky – postupně rostou, největší jsou během adolescence.[3]
Links
Related articles
- Primární imunodeficience • Defekty buněčné imunity • Defekty humorální imunity • Těžká kombinovaná imunodeficience
References
- ↑
- ↑ http://fvl.vfu.cz/export/sekce_ustavy/mikrobiologie/imunologie/Prednasky/02_8_bunky_organy_bariery.pdf
- ↑ Jump up to: a b c d e f g http://www.vfn.cz/pracoviste/kliniky-a-oddeleni/klinika-detskeho-a-dorostoveho-lekarstvi/
- ↑ http://jeeves.mmg.uci.edu/immunology/CoreNotes/Chap17.pdf
- ↑ Jump up to: a b eamos.pf.jcu.cz/amos/kpk/externi/kpk_2816/8.ppt